在本期「CR曙光」栏目中,淋巴瘤之家对河南省肿瘤医院刘艳艳教授团队进行了专访,分享了一位移植两个月后复发的弥漫大B淋巴瘤患者,通过CAR-T获得完全缓解后重返工作岗位的治疗经过以及引发的思考。
案例详情 患者:男性,38岁。 发病及治疗经历 外院就诊及治疗经历 2023年3月,因上腹部疼痛就诊,后确诊为弥漫性大B细胞性淋巴瘤(非生发中心亚型),基因检测结果显示P53缺失;后给予R-CHOP方案 1个周期,R-DA-EPOCH方案2个周期的治疗,疗效为PR(部分缓解); 2023年6月,行自体造血干细胞采集后,又完成了R-DA-EPOCH方案 4周期治疗; 2023年10月,在PET-CT评估见新发代谢灶后,仍完成了自体造血干细胞移植,并于两个月后出现疾病进展。 本院就诊经历 2024年1月,给予腹膜后、左侧腰大肌前淋巴结局部放疗; 2024年2月,行FC方案预处理后,完成 CAR-T细胞回输,回输后CR至今。
主管医生访谈录
患者是一名38岁青年男性,就诊于我院时已历经两线治疗,且在自体造血干细胞移植(ASCT)后两个月遭遇短期复发,情绪十分焦虑。综合其详尽病史与治疗历程分析,患者为复发难治性的弥漫大B细胞淋巴瘤(R/R DLBCL),鉴于传统化疗及靶向药物疗效有限,我们决定尝试CAR-T细胞疗法,以期为患者带来完全缓解(CR)的新希望。
自体移植与CAR-T间如何做单选和双选
通过基因检测,我们排除了双打击或三打击的不良预后因素,但发现TP53缺失,预示中高危状态。依据治疗指南,此类患者应在初治6至8疗程后,达CR或PR即行自体造血干细胞移植(ASCT)以巩固疗效。回顾患者治疗过程,其虽已完成干细胞采集,但移植前新发约2cm病灶,提示其对化疗反应不佳,预示单独做ASCT后未来复发风险仍较高。
所以,我们认为患者在发现新发病灶后进行ASCT并不是最优的方案,这时候如果可以通过ASCT序贯CAR-T治疗,比单独的ASCT疗效更佳。但这样的治疗相对更复杂,患者可能面临的风险也更高,在基层医院开展难度比较大,需要向有治疗经验的大型的综合医院寻求更优的治疗方案。
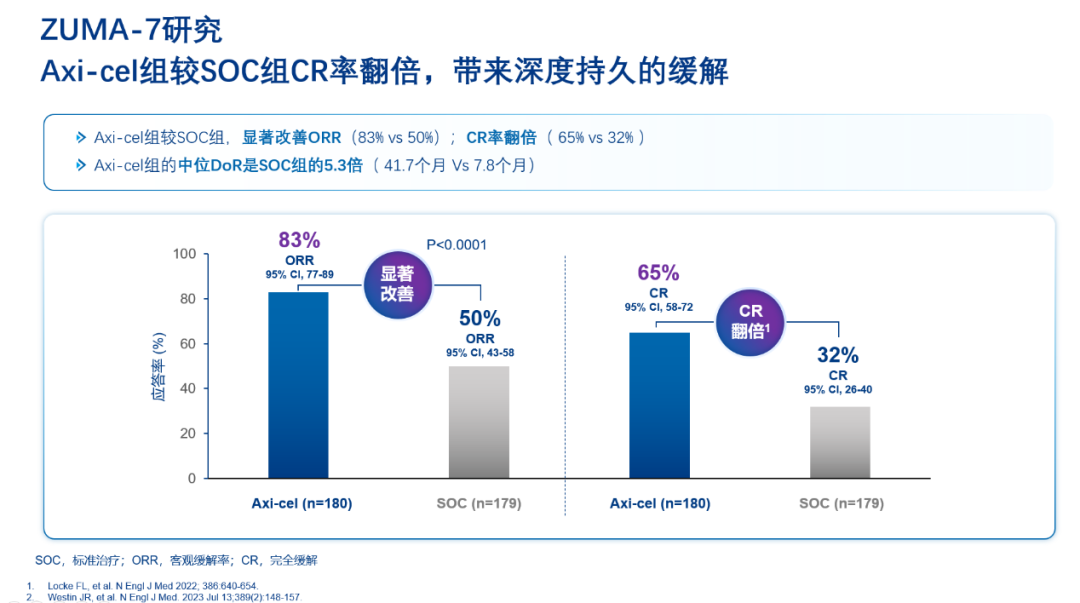
同时,针对原发难治性大B细胞淋巴瘤,我们推荐将CAR-T治疗提前至二线治疗阶段,这较之于标准的ASCT治疗方案可能获得更优疗效。ZUMA-7研究数据强有力地支持了这一点,显示CAR-T治疗在缓解率(CR)、无事件生存期(EFS)及总生存期(OS)上均显著优于标准ASCT方案,且安全性也得到了验证。
预处理方案的差异化考量
ASCT与CAR-T治疗前的预处理虽同为关键步骤,旨在优化治疗效果,但两者目的与机制迥异。ASCT目的是在自体干细胞支持下,通过大剂量的化疗,把体内残留的肿瘤细胞进一步杀灭以达到清除残留肿瘤,走向治愈的目标,预处理方案也是需要配合这个目标,侧重于进一步把体内残留的肿瘤细胞杀灭。
而CAR-T治疗中的预处理治疗,并非要达到杀伤体内残留的肿瘤细胞的目的,而是为了清除体内的淋巴细胞、免疫性的抑制性的T细胞,为CAR-T细胞回输后的扩增腾出必要的空间,创造一个有利于CAR-T细胞扩增和存活的环境。因此CAR-T治疗中的预处理方案,对肿瘤的杀伤作用有限,主要目标是清除体内的稳态细胞因子。
本例患者CAR-T回输后耐受性佳,未见严重不良反应,并于一个月内达CR,持续随访中保持良好状态,患者目前已重返工作岗位。
本案例的更多探讨
PET-CT及基因检测的重要指导意义
PET-CT可作为早期识别原发难治性淋巴瘤的关键工具,在治疗全程中发挥监测作用。医生可以通过4个疗程化疗后的中期PET-CT评估,及时判断患者是否有原发耐药的特点,调整治疗策略。同时基因检测为精准治疗提供重要依据,避免治疗盲目性,让患者在治疗过程中少走弯路。例如,患者通过基因检查发现双打击或三打击,那在接受传统的化疗或靶向治疗后如不能CR,后续就可以放弃传统ASCT策略,尽早计划CAR-T治疗。除了常规免疫组化的病理检测,NGS 、FISH检测同样能为临床治疗提供有价值的信息,患者应尽可能配合进行相关检测。
桥接治疗非常关键
鉴于CAR-T细胞制备周期长(约20天),期间肿瘤细胞可能快速增殖,需进行桥接治疗以控制肿瘤负荷,避免快速进展影响CAR-T疗效及增加回输后的不良反应。因此,桥接治疗对于肿瘤负荷大的患者非常关键。
目前来说,桥接治疗手段既可以用传统的化疗,也可以用靶向药物或PD-1、PD-L1等免疫制剂,以及局部放疗。我们结合患者治疗史,决定使用局部放疗作为桥接治疗方案,因其低中断率、高耐受性及良好的局部控制效果,尤其适用于化疗不敏感患者。
T细胞的采集可以前置
对于原发难治性的淋巴瘤患者,无论后续是否把CAR-T治疗纳入计划,我建议应该尽早进行T细胞的采集,无需等到确认使用CAR-T治疗作为挽救治疗方案后才进行采集。这主要是因为患者经历多轮的治疗,其T细胞的采集和制备可能变得困难重重,无形中剥夺了使用CAR-T这一重要治愈途径的可能性。
因此,建议经济条件允许的患者早期就可行T细胞采集,让后面的治疗有备无患,且T细胞采集后在一年的储存期内,能够保持足够的活性。
专家寄语
在探索血液肿瘤治疗的新篇章中,CAR-T细胞疗法无疑为我们点亮了一盏明灯。它不仅重新定义了难治及复发性淋巴瘤的治疗格局,更为无数患者开启了生命的新希望。我们期待,随着研究的不断深入与临床应用的日益广泛,CAR-T疗法能够在更多患者群体中展现其非凡潜力,让即使面对重重挑战如TP53缺失的勇士们,也能重拾健康,回归他们热爱的工作与生活,享受每一个被希望照亮的日子。
专家介绍

郑州大学博士研究生导师 郑州大学附属肿瘤医院副院长 河南省肿瘤研究院淋巴瘤研究所所长 上海交通大学内科学博士,美国Nebraska大学医学中心博士后 中国老年医学学会血液学分会常委 CSCO抗肿瘤药物安全委员会委员 中国抗癌协会淋巴瘤专业委员会委员 河南省抗癌协会淋巴瘤专业委员会副主任委员 河南省医学会肿瘤学分会常委、血液学分会常委 河南省卫生系统优秀归国人才,河南省学术技术带头人,河南省优秀青年科技专家,河南省政府特殊津贴,中原科技创新领军人才 主持国家自然科学基金面上项目5项,主持和参与国际、国内和自主发起临床研究20余项,发表研究论文40余篇, SCI累及影响因子200余分。

|  /1
/1 