- 主题
- 8
- 您的身份
- 病友
- 病理报告
- 弥漫大b细胞
- 目前状态
- 治疗中
参加活动:0 次 组织活动:0 次

您的身份病友
病理报告弥漫大b细胞
目前状态治疗中
最后登录2025-1-23
|
美国癌症学会学报
Cancer /Volume 124, Issue 24 p. 4622-4632
评论文章
淋巴瘤中的双打击和双表达:定义和治疗
Peter ARiedell MD,Sonali M. Smith MD
首发:2018年9月25日
Https://doi.org/10.1002/cncr.31646
引文:77
摘要
简单介绍
DHL和DEL的异常打击是什么?
定义DHL和DEL
基因组异常的特定模式在HGBL中重要吗?
双打击和双表达DLBCL的临床特征
所有患者都需要DHL检测吗?
DHL和DEL的最佳治疗方案是什么?
所有患者都需要强化诱导治疗吗?
中枢神经系统预防在DHL和DEL中的作用是什么?
在第一次完全缓解期间,综合自体干细胞移植有作用吗?
复发时的治疗方案是什么?
摘要
在对侵袭性B细胞淋巴瘤进行标准化免疫治疗后,新出现的生物学上亚型和新的预后标志物对治愈能力有显著的不利影响。识别MYC和B细胞CLL/淋巴瘤2(BCL2)异常,无论是在基因组还是蛋白质水平,都开启了在最常见的侵袭性B细胞淋巴瘤亚型中研究的新时代。双打击淋巴瘤(DHL),定义为MYC和BCL2和/或B细胞CLL/淋巴瘤6(BCL6)基因的双重重排,是一个罕见的亚型,占所有弥漫性大B细胞淋巴瘤(DLBCL)的5%至7%,长期幸存者很少见。双表达淋巴瘤(DEL)被定义为与潜在染色体重排无关的MYC和BCL2蛋白的过度表达,在当前的世界卫生组织分类中不是一个独特的单元,但占DLBCL病例的20%至30%,并且结果不佳。在识别、确定预后和治疗DHL和DEL方面,有许多实际考虑因素。
引言
弥漫性大B细胞淋巴瘤(DLBCL)越来越被认为是一种非常异质性疾病,其特征可以具有不同的病理亚型、形态变异和基因表达特征。1,2在大多数DLBCL病例中,利妥昔单抗、环磷酰胺、阿霉素、长春新霉素和强的松(R-CHOP)的化学免疫疗法有各不相同的治愈率,平均为70%。治疗结果很大程度上受许多因素影响,包括年龄, IPA指标,分子细胞起源类型及特定染色体重排和蛋白质表达的存在/缺失。按新的世界卫生组织指南,现在标准是决定分子亚型;这凸显了对基因组改变对疾病生物学和预后影响的深刻理解。与B细胞CLL/淋巴瘤2(BCL2)和/或B细胞CLL/淋巴瘤6(BCL6)重组的患者现在被正式归类为具有新的诊断个体,称为高级B细胞淋巴瘤(HGBL),这些重排通常分别称为双打击淋巴瘤(DHL)或三打击淋巴瘤(THL)。此外,没有潜在重排的MYC和BCL2蛋白的共表达被认为是一种新的不良预后指标,称为双表达淋巴瘤(DEL)。7在此,我们回顾了DHL作为一个独特的亚型,以及DEL对疾病生物学、临床表现和诊断评估的影响,进而对当前治疗所考虑的因素的给出切合实际的讨论。
DHL和DEL的异常打击是什么?
MYC
MYC原癌基因位于8q24染色体上,编码在代谢、蛋白质合成和细胞分化等方面具有各种作用的转录因子。在淋巴瘤的背景下,MYC的表达会导致基因组不稳定性、基因扩增和细胞增殖。8 MYC也可以自相矛盾地通过增加肿瘤抑制因子TP53.9-11的表达来抑制细胞凋亡。为了克服这种情况,MYC需要其他遗传事件(例如,BCL2的表达和TP53中的突变)来促进增殖和肿瘤发生。8 MYC重排与扩增密切相关。
由于多种机制,包括染色体易位、MYC基因扩增、基因内的突变和拷贝数改变,MYC蛋白的表达增加。13、14 MYC失调的精确机制和MYC基因内突变的存在都会影响MYC蛋白的表达水平。导致MYC蛋白过度表达的最经常观察到的紊乱涉及MYC转位到免疫球蛋白基因(IG)位点。IG启动子的构成活性导致信使RNA水平和相关MYC蛋白表达的强劲增加。MYC-IG重排是BL的标志,在大约60%的HGBL病例和少数DLBCL.1,15-17病例中,作为定义特征。然而,在大约5%的DLBCL病例中,MYC重排可能涉及非IG合作伙伴,如BCL6、BCL11A或PAX5。与MYC-IG重排相反,这些畸变通常会导致信使RNA和MYC蛋白表达较低,并且可能不会预后不佳。18-21最后,在大约2%至20%的DLBCL病例中注意到MYC基因扩增,尽管对MYC蛋白表达水平和预后的影响尚不清楚,文献中发现不一致。22-26
BCL2
BCL2是一种位于18q21号染色体上的癌基因,编码一种促生存蛋白,其功能是通过抑制细胞凋亡来维持细胞活力。在正常的淋巴细胞中,氧化应激、基因组不稳定和其他不利因素会诱导BH3家族蛋白质的表达,该蛋白的功能是抑制BCL2,从而允许凋亡的发生。27在恶性淋巴瘤的情况下,BCL2的过度表达与MYC和其他癌基因协同作用,并促进淋巴瘤的进展和对化疗的耐药。28,29 B BCL2失调可被视为染色体易位和基因扩增的结果,也与核因子B信号的增加有关。30
BCL6
BCL6作为癌基因发挥作用,位于3q27号染色体上。BCL6蛋白作为转录抑制剂,有助于控制许多细胞过程,包括激活、分化和细胞凋亡。在正常B细胞中,BCL6是生发中心反应的关键调节因子,并调节生发中心B细胞(GCB)的凋亡反应。具体来说,BCL6抑制P53、MYC和BCL2家族蛋白质的活性。涉及BCL6的易位通过阻止后生发中心B细胞中正常的BLC6蛋白下调来促进淋巴瘤。31-33
定义DHL和DEL
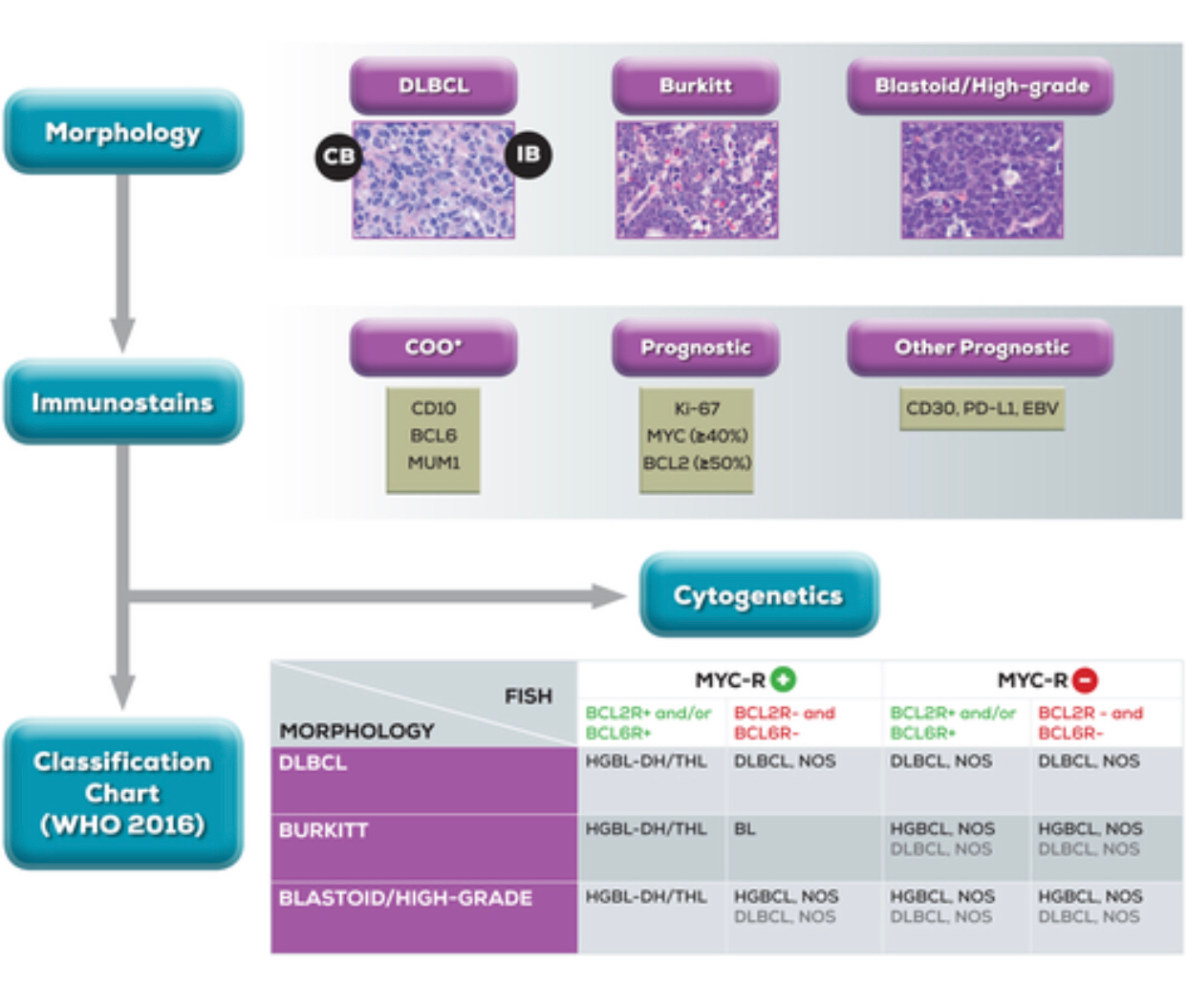
在修订后的世卫组织分类中,侵袭性B细胞淋巴瘤分类的起点是病理外观,具有以下形态学描述之一:母细胞、Burkitt、DLBCL/BL或DLBCL(如图所示)。1)。第二步是细胞遗传学或荧光原位杂交(FISH)测试,用于MYC、BCL2和BCL6的重排。如果MYC与BCL2或BCL6(或两者)共同重排,则诊断为HGBL与MYC和BCL2和/或BCL6重排;这也分别称为DHL或THL。如果没有这些重排,那么诊断将回到到形态,并可能分别称为HGBL,未另行指定(NOS)、DLBCL、NOS或BL。世卫组织2008年分类的诊断实体“B细胞淋巴瘤,不可分类,具有DLBCL和BL之间的中间特征”已被放弃,这些病例现在被重新归类为HGBL.1,7总共,大约65%的患者被归类为MYC与BCL2的DHL易位,14%的患者在MYC与BCL6中表现出易位,其余21%的患者有所有同时具有双蛋白表达的DHL。15,35
Figure 1
尽管所有 DHL 和 THL 病例中的大多数将共同表达各自的蛋白质,但反之则不一定成立。 如前所述,MYC 和 BCL2 蛋白共表达(无潜在基因组重排)的患者现在被认为患有 DEL。 重要的是,DEL 被认为是不良预后指标,但不是 DLBCL 的单独诊断实体。 MYC ≥ 40% 和 BCL2 >50% 的免疫组织化学阈值用于定义 DEL。7 MYC 和 BCL2 过表达可能归因于基因扩增和在没有染色体易位的情况下的翻译后过程。 30, 36, 37
MYC 拷贝数增加或基因扩增也可能发生在 8% 至 20% 的 DLBCL 病例中,尽管其对预后的影响尚不清楚。 22, 23, 38 Landsburg 等人26 比较了 22 名 MYC 扩增淋巴瘤患者的结果,87 单发淋巴瘤患者和 127 名无 MYC 扩增或重排的患者。 在这个主要接受 R-CHOP 治疗的人群中,MYC 扩增患者的表现与 MYC 阴性患者相似。 Testoni 等人的一项回顾性分析还表明,MYC 扩增与不良预后无关,除非同时伴有 8 号染色体缺失。最近,Quesada 等人39 还评估了基因扩增对 DLBCL 的影响。 在他们对 663 例新发 DLBCL 病例的分析中,12% 的患者存在 MYC 过度表达。 在该组中,多变量分析显示 MYC 扩增与较差的总生存期 (OS) 相关。 同样,双重或三重额外拷贝淋巴瘤患者(由 MYC 和 BCL2 和/或 BCL6 扩增定义)与具有双重或三重打击表型的患者表现相似。 总之,数据表明 MYC 扩增可能与 DLBCL 的较差结果相关; 然而,需要进一步的研究来更全面地评估其预后影响。
在生物学方面,实体DHL和预后组DEL与COO的概念重叠。 COO 模型于 2000 年首次提出,确定了 DLBCL 中的 2 种基因表达模式,这些模式是根据与正常 GCB 或正常活化 B 细胞 (ABC) 的相似性命名的,GCB DLBCL 患者的生存率更高。 5, 40 , 41 由于免疫组织化学比基因表达谱更常用于评估 COO,因此这些术语已演变为 GCB DLBCL 和非 GCB DLBCL(包括 ABC DLBCL 和其他非 GCB 样本)。 42
关于 COO,80% 到 90% 的 DHL 病例与 GCB DLBCL 同时发生。43-45 同样,DEL 似乎与非 GCB 亚型高度相关,回顾性研究表明 63% 的非 GCB DLBCL 病例带有 双蛋白表达与 37% 的 GCB DLBCL 病例相比。43 此外,在每个 COO 组(GCB 或非 GCB)中,MYC 和 BCL2 过表达的存在赋予较差的无进展生存期 (PFS) 和 OS.44
基因组异常的特定模式在 HGBL 中是否重要?
尽管同时伴有 MYC/BCL2 或 MYC/BCL6 重排的 DLBCL 被称为 DHL,但共同重排对预后的影响研究较少。 在最大的 DHL 患者系列中,MYC/BCL2 和 MYC/BCL6 重排 DHL 病例的 OS 没有显着差异,尽管在本研究中,59% 的 MYC/BCL6 患者也携带 BCL2 重排 (THL)。 46 相反 在 Aukema 等人的一项研究中,21 例 MYC/BCL6 重排的患者在排除 THL 患者后表现出明显比 MYC/BCL2 患者更差的 OS。 同样,在 Landsburg 等人的一系列研究中,34 名 MYC/BCL6 DHL 患者与 MYC/BCL2 DHL 或 THL 患者(分别为 34.8 个月和 17.2 个月)相比,中位 OS 明显更短,为 14.5 个月。
相比之下,其他人提出 MYC/BCL6 DHL 患者的预后可能不如 MYC/BCL2 DHL 患者那么差。 Ye 等人45 还比较了 MYC/BCL6 DHL 患者与 MYC/BCL2 DHL 患者的结局。 作者得出结论,与具有 MYC/BCL2 重排的 DHL 不同,并发的 MYC/BCL6 重排与接受 R-CHOP 治疗的患者的不良结果无关。 同样,Copie-Bergman 等人 20 根据伴侣基因重排评估了 DHL 患者的结果。 在他们的分析中,与 MYC/BCL6 DHL 相比,MYC/BCL2 DHL 患者的 PFS 和 OS 有更差的趋势,尽管这没有达到统计学意义。 尽管上述研究存在固有局限性,但这些数据确实让人质疑 MYC/BCL6 DHL 和 MYC/BCL2 DHL 在预后方面是否相同。
最近,还出现了突出 TP53 突变和 p53 过表达对 DHL 的潜在影响的数据。 已在 20% 至 30% 的 DHL 患者中发现 TP53 突变,并被认为导致该实体的不良预后。 47, 48 在 Gebauer 等人的一项研究中,47发现 TP53 突变在 MYC/ BCL2 DHL 与经典 DLBCL 或 DHL 与 MYC/BCL6 重排的比较。 作者推测,在这种情况下,TP53 突变可能通过抑制细胞凋亡与 BCL2 易位协同作用,此外,这种组合可能在克隆进化中赋予竞争优势。 有趣的是,Clipson 等人 49 指出,具有 MYC 重排和 TP53 突变的 DLBCL 患者的生存率低于 MYC/BCL2 DHL 患者,这表明需要在 MYC 重排的 DLBCL 病例中评估 TP53 突变。 Wang 等人 11 还评估了 p53 表达对 MYC 重排 DLBCL、MYC 过表达 DLBCL、MYC/BCL2 DHL 和 DEL 的影响。 在该系列中,p53 过表达(定义为≥50% 的阳性细胞)出现在 33% 的可评估病例中,并且与不良预后相关,尤其是在伴有 MYC 重排、MYC 过表达和 DEL 的 DLBCL 中。 总之,现有数据表明 TP53 突变和 p53 过表达都可能导致 DLBCL 患者的预后较差。 未来,需要前瞻性研究来证实这些发现,并帮助根据基因组异常模式更好地描述结果和最佳治疗方法。
双打击和双表达DLBCL的临床特征
DHL
DHL 患者经常出现侵袭性临床特征。 在 Tomita 等人的一项分析中,50 在 27 名 DHL 患者中,92% 表现出乳酸脱氢酶 (LDH) 水平升高,93% 患有结外疾病,87% 表现出高危 IPI 评分。 在 MD 安德森癌症中心的一项回顾性分析中,51 84% 的 DHL 患者患有晚期疾病(III/IV 期),65% 为男性,69% 的病例中 LDH 升高。 Petrich 等人 46 在对 311 名 DHL 患者进行的多中心回顾性分析中报告了类似的发现。 在他们的研究中,67% 的患者为男性,81% 的患者表现出晚期疾病,76% 的患者被发现 LDH 水平升高。 据估计,DHL 发生在大约 5% 到 12% 的 DLBCL 病例中。 52, 53
DEL
DEL 也有不同的临床表型,正如 Green 等人所证明的那样。43 在他们的回顾性分析中,DEL 患者的中位年龄为 71 岁,而没有双打击或双表达 DLBCL 的患者的中位年龄为 62 岁 . 此外,DEL 患者更有可能表现不佳、晚期疾病、较高的 Ki-67 增殖指数、中/高风险至高风险 IPI 评分、多个结外疾病部位和不良 R-CHOP 化疗的完全缓解率。 与 DHL 相比,DEL 在临床实践中更为常见。 在 Johnson 等人的一项研究中,15 18% 的分析患者表现出 BCL2 和 MYC 的双重过度表达。 同样,在 Hu 等人的一项研究中,44 34% 的患者表现出这些畸变。 总体而言,估计 20% 至 30% 的 DLBCL 患者会出现 DEL。
是否所有患者都需要 DHL 检测?
尽管修订后的 WHO 分类正式承认具有 MYC 和 BCL2 和/或 BCL6 重排的 HGBL 作为新的诊断实体,但它没有提供关于在组织有限或资源稀缺的情况下哪些大 B 细胞淋巴瘤需要 FISH 检测的指南。 7 此外,尽管 DHL 患者经常表现出更具侵袭性的病程,但不幸的是,Ki-67 增殖指数升高、晚期疾病和 LDH 水平升高等高风险特征并不是 DHL 普遍可靠的指标。 54 明确 排除 DHL,则需要用 FISH 检测所有侵袭性淋巴瘤标本。 虽然应该强调的是,强烈推荐全面的筛选策略,但在统一采用这种方法之前,必须考虑成本、可用资源和其他医疗服务问题。 这在资源匮乏的地区尤其重要,因为在这些地区测试所有标本在经济上和医疗服务上都不可行。 鉴于此类考虑,并且由于 DHL 仅见于 5% 至 12% 的 DLBCL 病例,许多中心在 FISH 分析方面采用了更具针对性的方法,尽管此类算法并非没有局限性。 52, 53
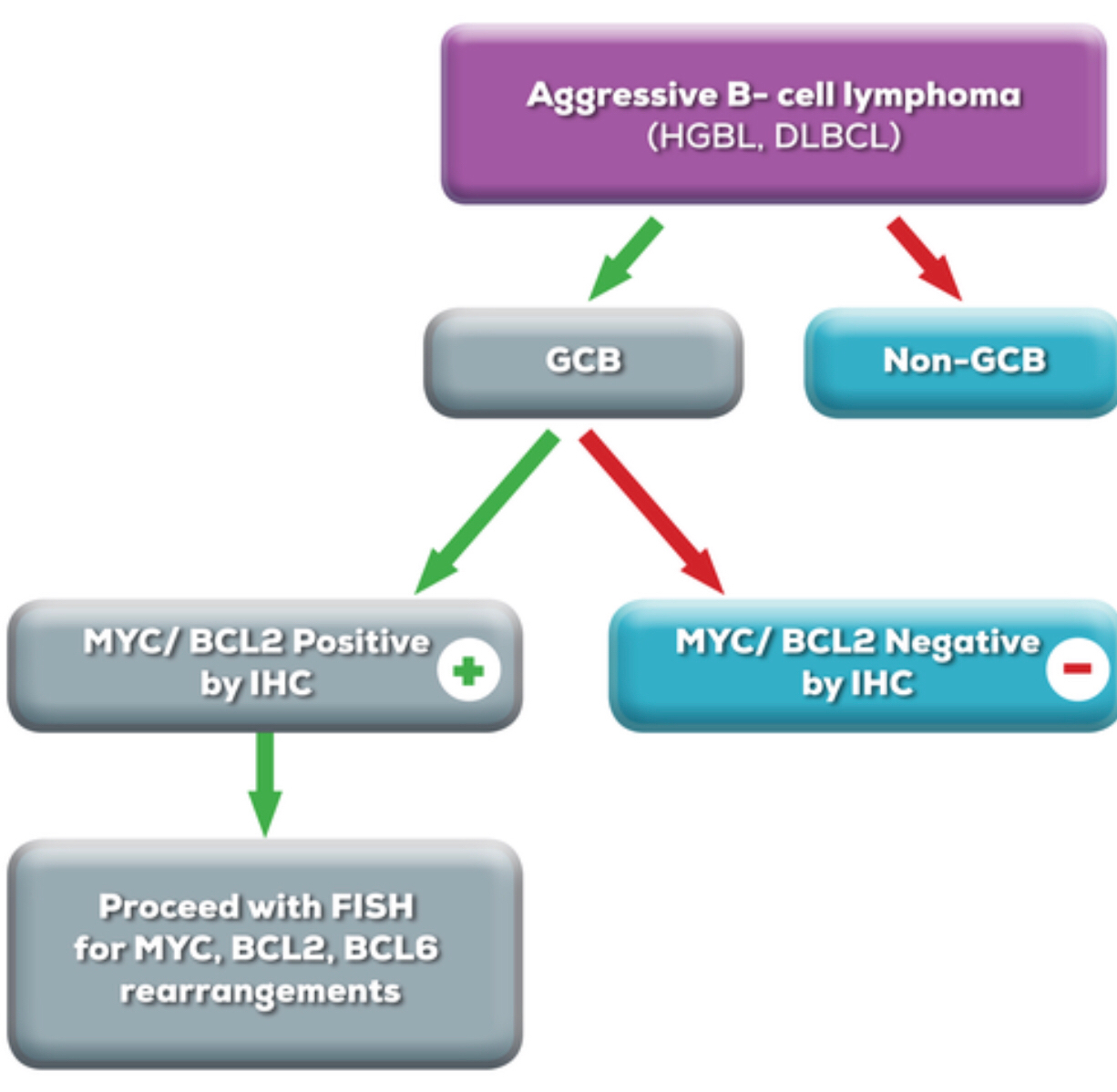
一种提议的方法涉及在初始免疫组织化学分析的基础上将 FISH 分析仅限于某些病例,其基本原理是绝大多数 DHL 病例 (>90%) 属于 GCB 亚型。 43 因此,病理标本可以首先 进行 GCB 衍生筛选; 如果我们假设多达一半的案例是非 GCB,这将大大减少样本数量。 其次,由于 80% 的 DHL 病例会出现 MYC 和 BCL2 蛋白过度表达,因此缺乏这些标记物将淘汰另一部分标本。 其余病例(GCB 衍生和通过免疫组织化学对 MYC 和 BCL2 呈阳性)应继续进行 FISH 以进行 DHL 评估。 此外,将 FISH 检测应用于富含 MYC 易位的其他疾病亚群是合理的,例如转化滤泡性淋巴瘤患者(见于 21% 的病例)和 BL 患者(见于约 100% 的病例)。 7, 55
另一种将 FISH 测试限制在 DHL 可能性最高的方法是使用 MYC 蛋白过表达作为筛选测试。 在 Rituximab 加 CHOP 超过 60 岁 (RICOVER-60) 研究的一部分患者中,分别有 47% 和 30% 的患者通过 FISH 和免疫组织化学获得 MYC 数据。 56 在总共 26 例 MYC 重排病例中,18 ( 69%)的 MYC 表达增加,以 ≥ 40% 作为截止点,这表明三分之一的 MYC 重排病例(8 名患者)会被遗漏。 Green 等人 43 使用 ≥ 70% MYC 过表达的更高截止点作为潜在 MYC 重排的筛选工具,他们发现非常高的灵敏度和特异性值分别为 100% 和 93%。 然而,大约 15% 到 20% 的 MYC 重排患者没有相应的蛋白质过表达。 总体而言,不推荐根据 MYC 蛋白表达筛选 DHL。
总之,理想的程序是在诊断时对所有侵袭性 B 细胞淋巴瘤患者进行 DHL 筛查,特别是因为对结果的严重负面影响和较差的 OS。 确认 MYC 重排的病例随后应接受进一步检测,包括 BCL2 和 BCL6 的 FISH。 虽然这种策略明显增加了成本,但我们认为与化疗和其他治疗相关费用相比,这笔费用的幅度很小。 在美国,基于 FISH 的检测是各种恶性肿瘤类型的标准检测,并且有许多商业实验室能够在 1 周的时间内处理和报告结果。 相反,在资源匮乏的地区,可能需要采用逐步方法,首先对患者进行 COO 和 MYC/BCL2 表达筛查,如果结果呈阳性,则转诊进行 FISH 分析(图 2)。
Figure 2
DHL 和 DEL 的最佳治疗方法是什么?
DHL
由于缺乏前瞻性数据,为 DHL 建立最佳诱导方案具有挑战性。 此外,由于该实体在文献中很少见,因此缺乏治疗数据来指导治疗决策。 几项大型回顾性数据集明确表明,接受 R-CHOP 诱导治疗的 DHL 和 DEL 患者的结局并不理想,因此,已经探索强化诱导方案以试图改善结局。 44、46 表 1 总结了 DHL 关键研究的结果。
Petrich 等人进行的最广的回顾性研究 46 检查了 311 名接受各种化疗方案治疗的 DHL 患者,包括 R-CHOP,以及其他强化诱导方案,包括利妥昔单抗、依托泊苷、泼尼松、长春新碱、环磷酰胺和多柔比星 (R-EPOCH)。 在分析中,作者指出,与强化诱导方案复合组相比,R-CHOP 疗法的中位 PFS 明显较差(7.8 个月与 21.6 个月;P = .001),尽管没有观察到 OS 获益 (P = .564) . 同样,MD 安德森癌症中心的一项回顾性研究评估了 129 名接受 DHL 治疗的患者的结果。 在分析中,与接受标准 R-CHOP 治疗的患者相比,接受 R-EPOCH 治疗的患者表现出更优的无事件生存期 (P = .004) 和 OS (P = .057)。 51 在对 11 项研究的荟萃分析中 包含 394 名患者,与 R-CHOP 相比,R-EPOCH 一线治疗与进展风险降低相关(相对风险降低 34%;P = .032),尽管未发现 OS 差异。 57 根据 在这些数据中,经常采用强度更高的诱导化疗,R-EPOCH 通常是首选方案,因为与其他强化方案相比,R-EPOCH 具有更有利的毒性特征。 Alliance 50303 随机 3 期研究 R-CHOP 与 R-EPOCH 在未治疗的 DLBCL 中的结果显示,R-EPOCH 方案未能改善无事件生存期 (P = .438) 和 OS (P = .42) 与 R-CHOP 的比较。58 值得一提的是,迄今为止,尚未提出任何亚型分析。 不幸的是,由于 DHL 和 DEL 的发生率相对较低,本研究不太可能明确回答这个问题。 尽管可用数据有限,但我们中心已采用 R-EPOCH 作为适合 DHL 患者的标准。 专门为 DHL 和 DEL 设计的前瞻性临床试验将理想地帮助我们更清楚地定义最佳治疗方法。 目前正在招募的研究包括 R-EPOCH 与 BCL2 抑制剂维奈托克 (NCT03036904) 和 R-EPOCH 与免疫调节剂来那度胺 (NCT02213913)。
DEL
双蛋白表达的存在已被证明会对 DLBCL 的临床结果产生负面影响。 在 Green 等人的一项研究中,43 将经 R-CHOP 治疗的 DEL 患者的结果与 MYC 或 BCL2 过表达患者以及没有这些畸变的 DLBCL 患者的结果进行了比较。 MYC 或 BCL2 过度表达(通常称为单一表达者)的患者表现出与没有此类异常的患者相似的结果。 相反,与单一蛋白或无蛋白的患者相比,DEL 患者的 3 年 PFS(39% 对 75%;P < .001)和 3 年 OS(43% 对 86%;P
|
|
 /1
/1 