- 主题
- 194
- 您的身份
- 病友
- 病理报告
- 滤泡性淋巴瘤1-2级
- 目前状态
- 已确诊,未治疗,观察随访中
参加活动:0 次 组织活动:0 次
您的身份病友
病理报告滤泡性淋巴瘤1-2级
目前状态已确诊,未治疗,观察随访中
最后登录2024-11-21
|
2024年6月26日,艾伯维宣布FDA已批准Epcoritamab(商品名:Epkinly)用于治疗至少接受过两种系统治疗的复发或难治性滤泡性淋巴瘤(R/R FL)患者。
FL属于非霍奇金氏淋巴瘤(NHL),是B细胞淋巴瘤中较常见的类型,约占NHL患者总数的20%-30%。最常见的表现是无痛性淋巴结肿大,典型表现为多部位淋巴组织侵犯,有时可触及滑车上淋巴结肿大。FL一般进展缓慢,患者生存期较长,易向弥漫大B细胞淋巴瘤转化,缓解后复发率极高。
FDA此次批准主要是基于I/II期EPCORETMNHL-1研究的积极结果。该研究是一项全球性、多中心、开放标签的临床试验,纳入了128例至少接受过两种系统治疗(其中一种是CD20抗体药物)的CD20阳性(CD20+)R/R FL成人患者,评估了Epcoritamab的安全性和初步疗效。
结果显示,经独立审查委员会(IRC)评估的总体缓解率(ORR)为82%,超过了方案预先设定的疗效阈值。中位随访14.8个月时,中位缓解持续时间(DOR)尚未达到(95%CI:13.7,NR),DOR达到12个月的患者比例估计为68.4%。
安全性方面,未观察到新的安全性信号。最常见的治疗期间不良事件(TEAE)是细胞因子释放综合征(66.4%),其中1.6%的事件严重程度超过2级。
Epcoritamab是Genmab利用其专有的DuoBody技术开发的一款IgG1双特异性抗体,可同时靶向T细胞上的CD3和B细胞上的CD20,诱导T细胞杀伤CD20+细胞。2020年6月,艾伯维与Genmab达成协议,共同开发和商业化包括该产品在内的3款双抗。
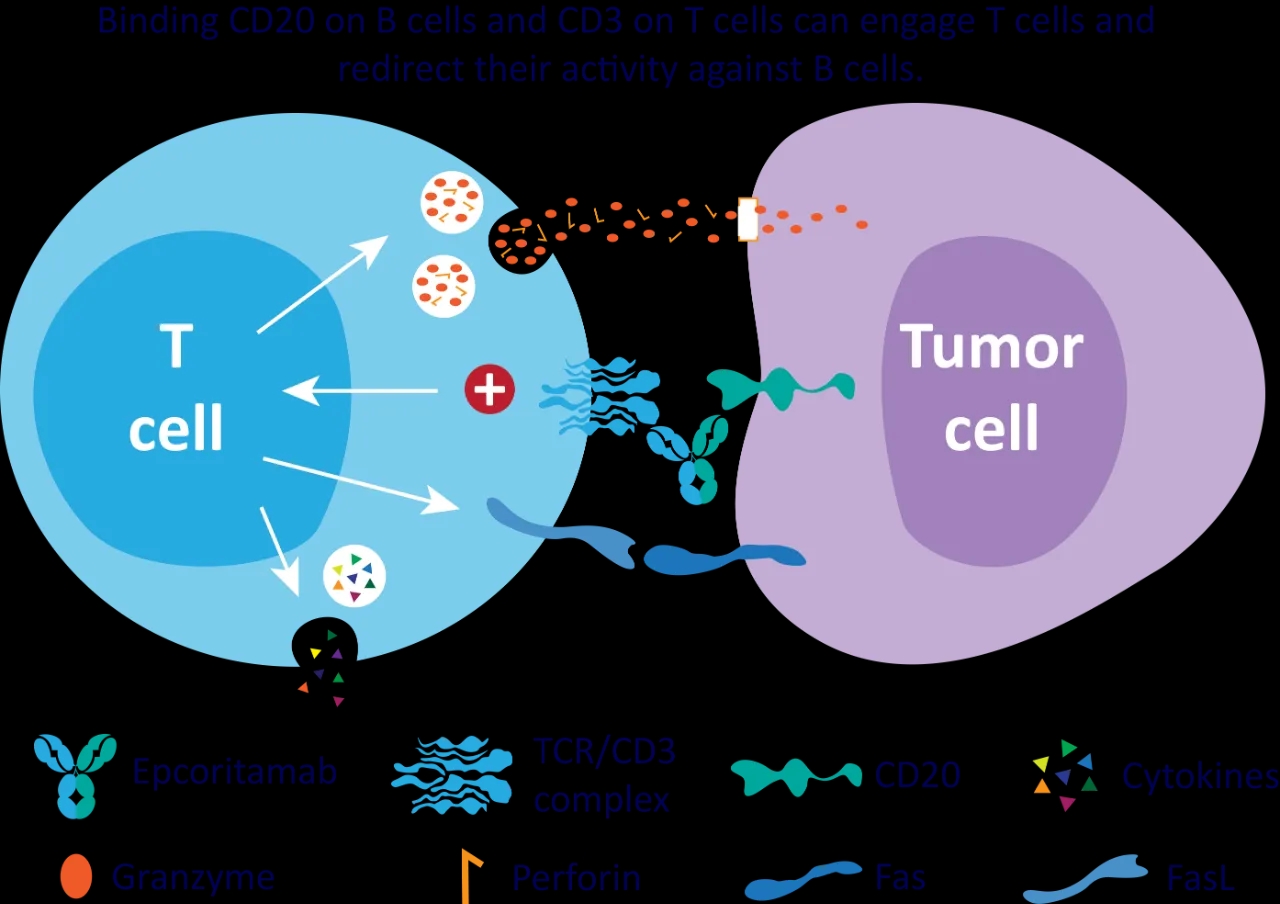
epcoritamab的作用机制(来源:艾伯维官网)
2023年5月,Epcoritamab首次在美国获批上市,用于治疗接受过二线或多线系统治疗的复发或难治性弥漫性大B细胞淋巴瘤(R/R DLBCL)患者。该产品也成为了首款应用于DLBCL领域的双抗产品,同时也是继Mosunetuzumab(莫妥珠单抗,渤健/罗氏)后获FDA批准上市的第2款CD3/CD20双抗。
该药物皮下注射,非常方便。处方信息上有一个针对严重或致死性CRS和免疫效应细胞相关神经毒性(ICANS)的黑框警告。警告和注意事项包括严重感染和血细胞减少。ICANS发生率为6.0%,严重感染发生率为40%。86例R/R FL患者接受了推荐的三阶梯剂量方案,其中49%发生了CRS,所有事件均为1级(45%)或2级(9%)。
最常见的不良反应(≥20%)为注射部位反应、细胞因子释放综合征、COVID-19感染、疲劳、上呼吸道感染、肌肉骨骼疼痛、皮疹、腹泻、发热、咳嗽和头痛。最常见的3~4级实验室异常(≥10%)是淋巴细胞计数减少、中性粒细胞计数减少、白细胞计数减少和血红蛋白减少。
推荐的治疗方案包括皮下注射epcoritamab-bysp,28天为一个周期,直到疾病进展或出现不可接受的毒性。推荐剂量为三阶梯剂量方案:第1周期(第1天0.16mg,第8天0.8mg,第15天3mg,第22天48mg);第2和第3周期(第1、8、15和22天48mg);第4~9周期(第1和15天48mg);第10周期及以后(第1天48mg)。
为了进一步验证 epcoritamab-bysp 的临床疗效,目前正在开展一项3 期随机试验(NCT05409066),旨在评估利妥昔单抗和来那度胺单独或与epcoritamab-bysp联合治疗R/R FL患者的疗效,目前入组已接近完成(95%)。
|
|
 /1
/1 