- 主题
- 395
- 您的身份
- 病友
- 就诊医院
- 北京协和
- 病理报告
- 滤泡性淋巴瘤1-2级
- 目前状态
- 康复10-20年
参加活动:0 次 组织活动:0 次
您的身份病友
病理报告滤泡性淋巴瘤1-2级
就诊医院北京协和
目前状态康复10-20年
最后登录2025-12-26
  
|
淋巴瘤患者,很多都会问这样的问题:Why me(为什么是我)?但是,这个问题往往没有答案,借用西方人喜欢说的一句话,那就是:Shit happens(倒霉的事总会发生),没有办法预测,也没有办法阻挡。
但是,今天我们要说的是,shit不仅仅happens,it matters too(它也很重要)。近些年来,在免疫治疗中发现一个非常有意思的现象,那就是肠道微生物群(Gut Microbiota)对免疫治疗的效果有很大影响,最初发现它影响到了免疫检查点抑制剂(例如PD-1单抗)的疗效,以及异基因移植的疗效,现在发现它对CAR-T疗法的反应和毒性也有影响。
人类肠道微生物群在调节宿主的炎症、代谢、免疫中起着重要的作用。肠道微生物群的破坏与肿瘤发生、治疗效果、肿瘤逃逸和免疫调节之间有密切的关系。例如,Yoon等人(1)最近报道,在一组新诊断的弥漫性大B细胞淋巴瘤的患者中,发现了肠道微生态失调,并且在R-CHOP方案化疗期间,肠杆菌科的高丰度与发热性中性粒细胞减少症和较低生存率相关。
到目前为止,已经发表了多项关于肠道微生物群在CAR-T治疗中作用的临床研究。尽管这些分析是回顾性的,但这些初步数据表明,肠道微生物群影响了CAR-T免疫疗法的反应和毒性。
在Smith等人(2)进行的第一项研究中,228例复发或难治性B淋母和大B细胞淋巴瘤患者接受了抗CD19 CAR-T治疗,CAR-T给药前4周内暴露于抗生素,特别是广谱厌氧菌靶向抗生素(哌拉西林-他唑巴坦、亚胺培南-西司他丁和/或美罗培南[PIM])导致α多样性降低(肠道α多样性是一个用来衡量个体内肠道菌群多样性的指标)。更重要的是,在多变量回归模型中,输注前PIM暴露与无进展生存率和总生存率的降低有关。此外,在淋巴瘤亚组中,CAR-T输注前暴露于抗生素的个体表现出更高的免疫效应细胞相关神经毒性综合征(ICANs)发生率。
最近,Stein-Thoeringer等人(3)在一组美国和德国的NHL患者中证实了这些数据,这些患者接受了axi-cel、tisa-cel或liso-cel输注,但在CAR-T输注前3周内未接触抗生素。研究显示,长双歧杆菌丰度和肽聚糖生物合成与长期生存率和对CAR-T的反应密切相关,与其它临床变量无关。
根据上述研究,Hu等人描述了在抗BCMA CAR-T治疗后获得完全缓解(CR)的多发性骨髓瘤患者中肠道微生物的不同模式。值得注意的是,他们发现不同的氨基酸代谢途径在应答者和无应答者中富集,并观察到双歧杆菌在CR患者中富集,与细胞因子释放综合征(CRS)相关。相比之下,由于队列中的事件数量较少,他们无法分析与神经毒性发生率和严重程度相关的微生物群。微生物群是否影响CRS仍然是一个悬而未决的问题。
目前,已经开发出各种治疗策略来调节肠道微生物群活性并增强免疫疗法的抗肿瘤效果,如粪便微生物群移植(FMT)、益生菌(Probiotics)、益生元(Prebiotics)、饮食和抗菌治疗的调整等,并且在接受免疫检查点抑制剂和异基因移植治疗的患者中取得了一些令人鼓舞的结果,提示这些干预措施在CAR-T中也有可能发挥作用。不过,CAR-T治疗患者的临床试验结果尚未成熟。
其中,FMT是将复杂和异质的微生物群落从经过病原体筛查的健康供体转移到受体,已成功用于治疗复发性艰难梭菌感染,在免疫检查点抑制剂治疗的患者和异体移植后急性移植物抗宿主病患者中也均显示出不错的效果。尽管如此,由于未知生物体的潜在传播和一些其它事项,例如缺乏大规模的过程控制和再现性,也存在安全问题。
一种备受推崇的方法是使用益生菌(Probiotics),即直接给予特定的细菌群或它们的组合来调节肠道微生物群。尽管在控制传染病复发和代谢紊乱方面取得了成果,益生菌与免疫疗法联合治疗癌症的效果仍存在争议。关键的问题是,到目前为止我们仍然无法确定究竟哪些细菌是真正的益生菌,而且对于不同的个体益生菌的种类和组成可能也是不一样的。有一些研究表明,特定的菌种也许不是最重要的,最重要的是菌种的多样性(Diversity)。
调节肠道微生物群的另一种方法是给予益生元(Prebiotics),这是一种刺激肠道中有益细菌生长和代谢的不易消化的膳食物质,如菊粉、低聚果糖和低聚半乳糖等。也就是说,虽然我们不太确定哪些是益生菌,也不知道应该怎么补充或者补充多少,但是可以想办法给肠道里这些益生菌提供更充足的食物,使其能够更好的繁殖,从而达到改善肠道微生物生态的目的。然而,益生元的使用也是充满争议。
还有一种风险更小的办法。最近,Spencer等人(4)证明,与纤维摄入不足的患者相比,纤维摄入充足的患者有更长的无进展生存期和更高的应答率,这与更大的微生物α多样性和瘤胃球菌科和粪杆菌丰度有关。此外,Simpson等人(5)报道,摄入更多纤维和ω-3的患者在免疫检查点抑制剂治疗后获得了更强的抗肿瘤免疫反应,并降低了毒性。总之,高纤饮食可能对免疫疗法产生有利影响,并在体内增强抗肿瘤T细胞反应,很多人呼吁在临床试验中研究不同的饮食结构对CAR-T治疗患者的潜在作用。
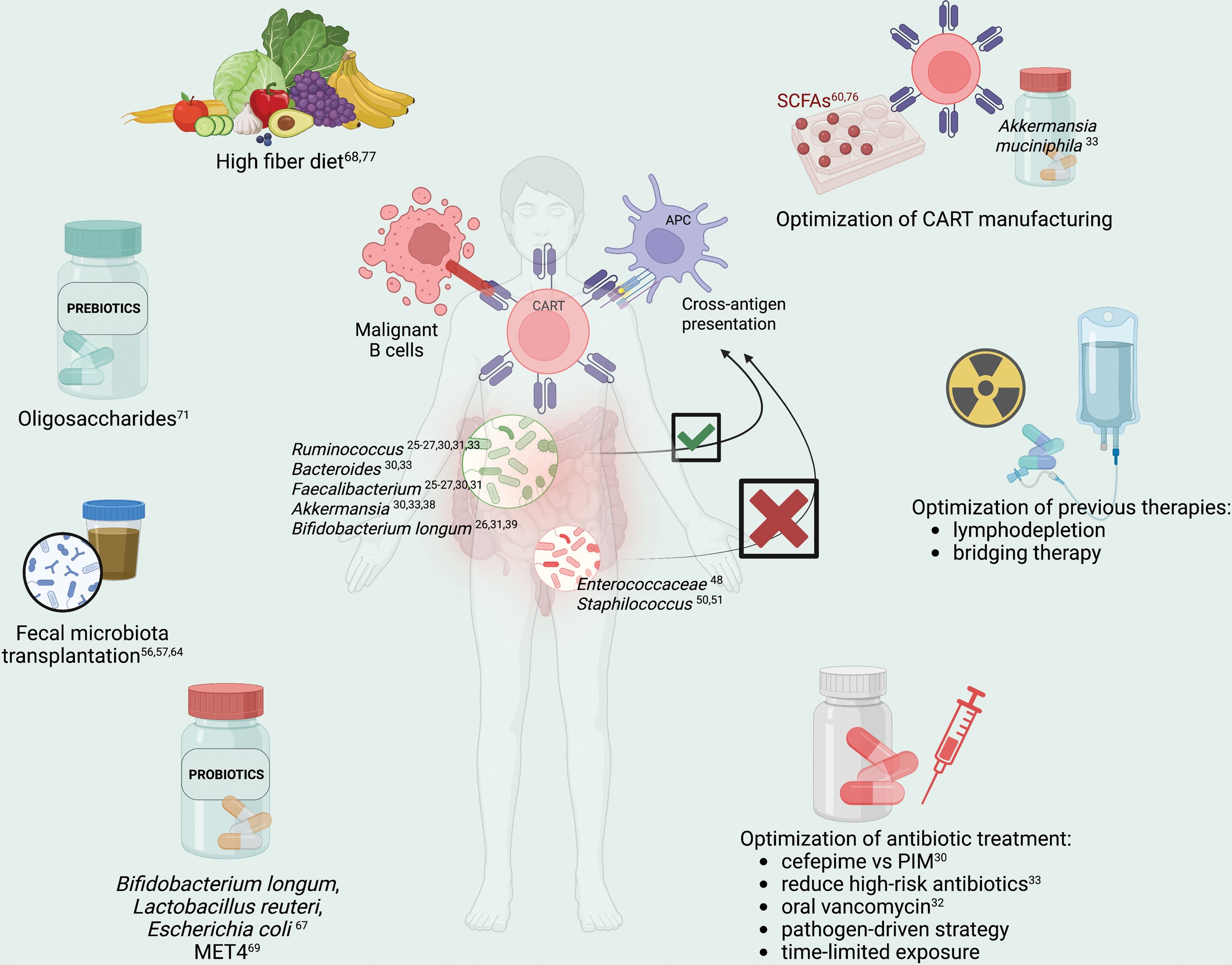
总结一下,尽管预临床和临床研究表明肠道微生物群在免疫调节中发挥着关键作用,但阐明其潜在机制仍然是一个挑战。常用于血液病患者的感染预防和治疗的抗生素,对肠道微生物群的组成有着深刻的影响,广谱抗生素会导致专性厌氧菌和肠道微生物代谢产物的严重耗竭,损害CAR-T等免疫疗法的疗效或与更高毒性有关,因此强烈建议采用病原体驱动的治疗策略,以保持微生物α多样性。高纤维饮食对调节细胞代谢和维持肠道微生物群多样性具有重要意义,是一种可行且具有很高的成本效益的方法。基于在免疫检查点抑制剂和异基因移植治疗的患者中所得出的结果,FMT可能是接受CAR-T治疗的患者感兴趣的问题,特别是那些有抗生素暴露的患者,所以,Shit Matters。
参考文献:
(1) Yoon SE, et al. The influence of microbial dysbiosis on immunochemotherapy-related efficacy and safety in diffuse large B-cell lymphoma. Blood. 2023 May 4;141(18):2224-2238. doi: 10.1182/blood.2022018831. PMID: 36724450.
(2) Smith M, et al. Gut microbiome correlates of response and toxicity following anti-CD19 CAR T cell therapy. Nat Med. 2022 Apr;28(4):713-723. doi: 10.1038/s41591-022-01702-9. Epub 2022 Mar 14. Erratum in: Nat Med. 2022 Oct 17;: PMID: 35288695; PMCID: PMC9434490.
(3) Stein-Thoeringer CK, et al. A non-antibiotic-disrupted gut microbiome is associated with clinical responses to CD19-CAR-T cell cancer immunotherapy. Nat Med. 2023 Apr;29(4):906-916. doi: 10.1038/s41591-023-02234-6. Epub 2023 Mar 13. PMID: 36914893; PMCID: PMC10121864.
(4) Spencer CN, et al. Dietary fiber and probiotics influence the gut microbiome and melanoma immunotherapy response. Science. 2021 Dec 24;374(6575):1632-1640. doi: 10.1126/science.aaz7015. Epub 2021 Dec 23. PMID: 34941392; PMCID: PMC8970537.
(5) Simpson RC, et al. Diet-driven microbial ecology underpins associations between cancer immunotherapy outcomes and the gut microbiome. Nat Med. 2022 Nov;28(11):2344-2352. doi: 10.1038/s41591-022-01965-2. Epub 2022 Sep 22. PMID: 36138151.
|
|
 /1
/1 